Zum Profil
Arbeitsgruppe
Bioorganische Chemie
M.-T. HoppKontakt
Forschung
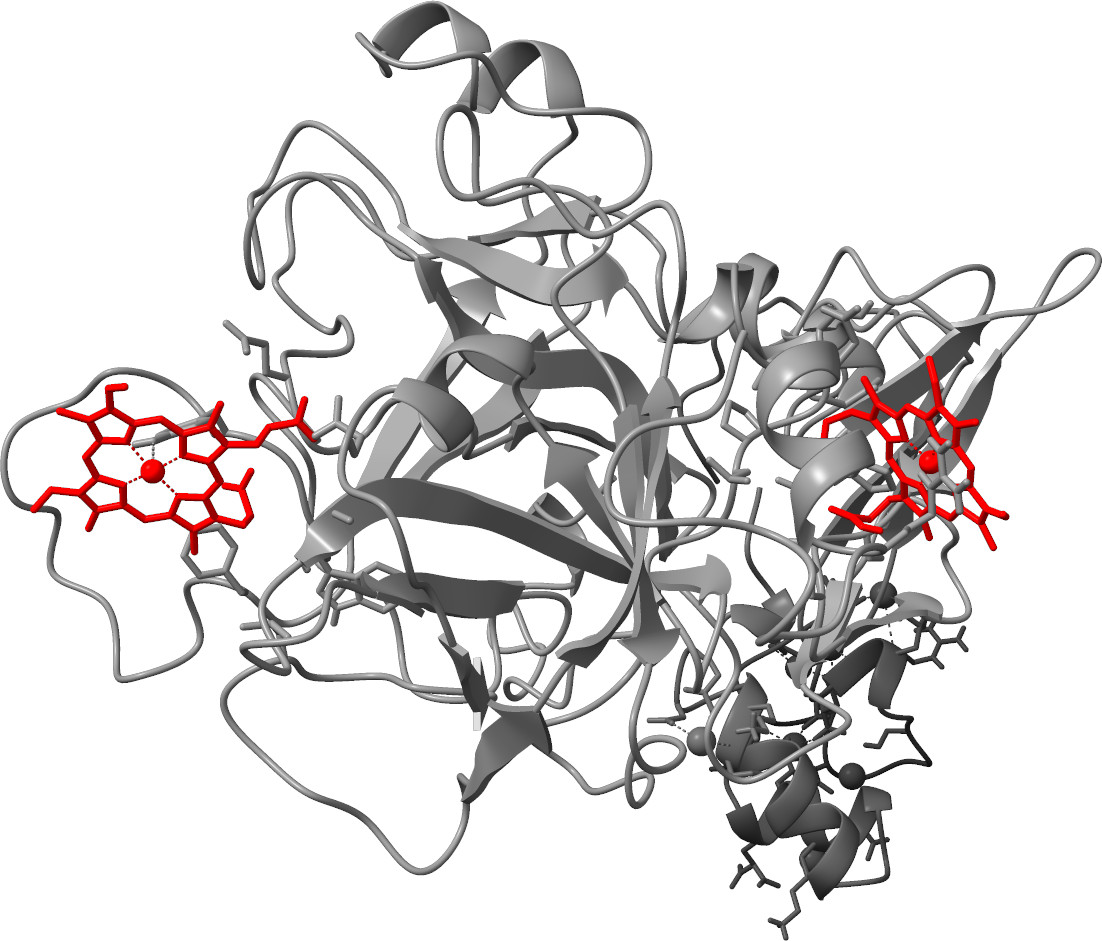
Unsere interdisziplinäre Forschung an der Grenzfläche von Chemie, Biologie und Medizin (Life Sciences) konzentriert sich auf die Verwendung von Peptiden als Werkzeuge zur Erforschung biologischer und (patho-)physiologischer Prozesse auf molekularer Ebene. Hierzu wird die organische Synthese von Oligo- und Polypeptiden bis hin zu Miniproteinen mittels Festphasenpeptidsynthese realisiert. Die Syntheseprodukte werden anschließend mithilfe bioanalytischer Methoden gereinigt und chemisch charakterisiert. Protein-/Peptid-Ligand-Interaktionen werden mittels biophysikalischer Techniken und Struktur-Funktions-Beziehungen über Methoden der klinischen Diagnostik analysiert. Ein besonderer Schwerpunkt unserer Arbeiten liegt auf der Erforschung von Häm-Protein-Interaktionen im Kontext der Entstehung von Hämolyse-/Hämorrhage-assoziierten Gerinnungsstörungen sowie der Analytik von Amphibiensekreten.

Unsere Arbeitsgruppe ist zudem Mitglied des interdisziplinären Instituts für Medizintechnik und Informationsverarbeitung Mittelrhein (MTI).
Lehre
Projekt- und Abschlussarbeiten können nach Absprache in den Forschungsbereichen der Arbeitsgruppe angefertigt werden. Aktuelle Ausschreibungen finden Sie hier.
Bei Interesse melden Sie sich bitte direkt bei Frau Jun.-Prof. Dr. Hopp (mhopp(at)uni-koblenz.de).

Wir unterstützen den Wettbewerb "Jugend forscht". Weitere Informationen finden Sie hier.
Aktuelles
Projekte
Publikationen (Auswahl)
Kröner, L., Lötters, S., Hopp, M.-T. (2024) Insights into caudate amphibian skin secretions with a focus on the chemistry and bioactivity of derived peptides. Biol. Chem., DOI: 10.1515/hsz-2024-0035
Hopp, M.-T.*, Ugurlar, D., Pezeshkpoor, B., Biswas, A., Ramoji, A., Neugebauer, U., Oldenburg, J., Imhof, D.* (2024) In-depth structure-function profiling of the complex formation between coagulation factor VIII and heme. Thromb. Res. 237: 184-195.
Hopp, M.-T., Holze, J., Lauber, F., Holtkamp, L., Rathod, D. C., Miteva, M. A., Prestes, E. B., Geyer, M., Manoury, B., Merle, N., Roumenina, L., Bozza, M. T., Weindl, G., Imhof, D. (2024) Insights into the molecular basis and mechanism of heme-triggered TLR4 signaling: The role of heme-binding motifs in TLR4 and MD2. Immunology 171(2): 181-197.
Hopp, M.-T., Rathod, D. C., Imhof, D. (2022) Host and viral proteins involved in SARS-CoV-2 infection differentially bind heme. Protein Sci. 31(11), e4451.
Hopp, M.-T., Alhanafi, N., Paul George, A. A., Hamedani, N. S., Biswas, A., Oldenburg, J., Pötzsch, B., Imhof, D. (2021) Molecular insights and functional consequences of the interaction of heme with activated protein C. Antioxid. Redox. Signal. 34(1), 32-48.