Forschung
AG Bioorganische ChemiePeptide sind durch ihre zahlreichen und vielseitigen Funktionen in der Natur bekannt, wo sie beispielsweise als Hormone (z.B. Oxytocin) und Entzündungshemmer (z.B. Melittin) agieren können oder auch als Toxine (z.B. a-Amanitin) produziert werden [1]. In den letzten Jahrzehnten haben sie darüber hinaus aufgrund ihrer Vielseitigkeit und Spezifizität auch in der chemischen, pharmazeutischen und kosmetischen Industrie an Bedeutung gewonnen, sodass heutzutage intensiv an neuen, natürlichen und synthetischen Peptiden geforscht wird [2]. In der bioorganischen, biochemischen und molekularbiologischen Forschung stellen Peptide wesentliche Werkzeuge dar, um wissenschaftliche Fragestellungen zu lösen.
[1] Daffre, S., Bulte, P., Spisni, A., Ehret-Sabatier, L., Rodrigues, E. G., Travassos, L. R. (2008) Bioactive natural peptides. Stud. Nat. Prod. Chem. 35, 597-691.
[2] Muttenthaler, M., King, G. F., Adams, D. J., Alewood, P. F. (2021) Trends in peptide drug discovery. Nat. Rev. 20, 309-325.
Häm/Thrombose-Forschung
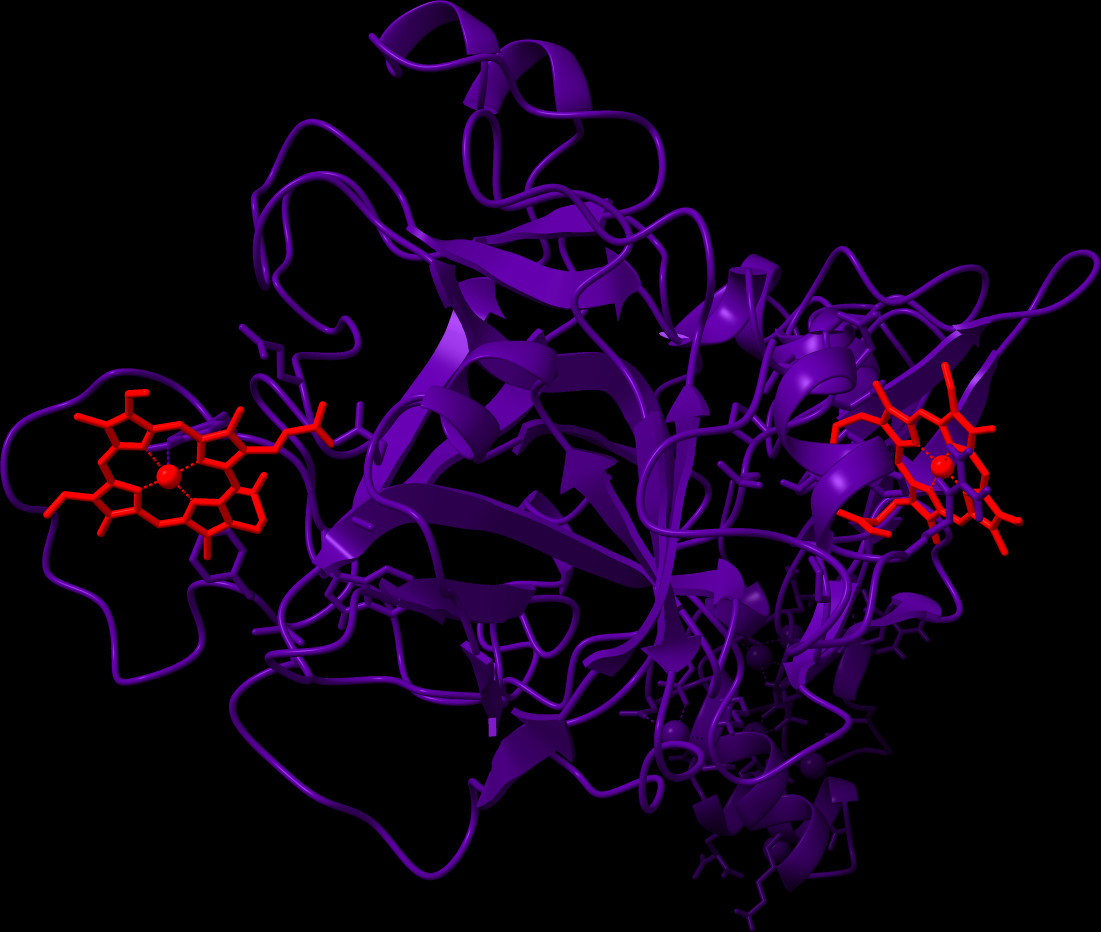
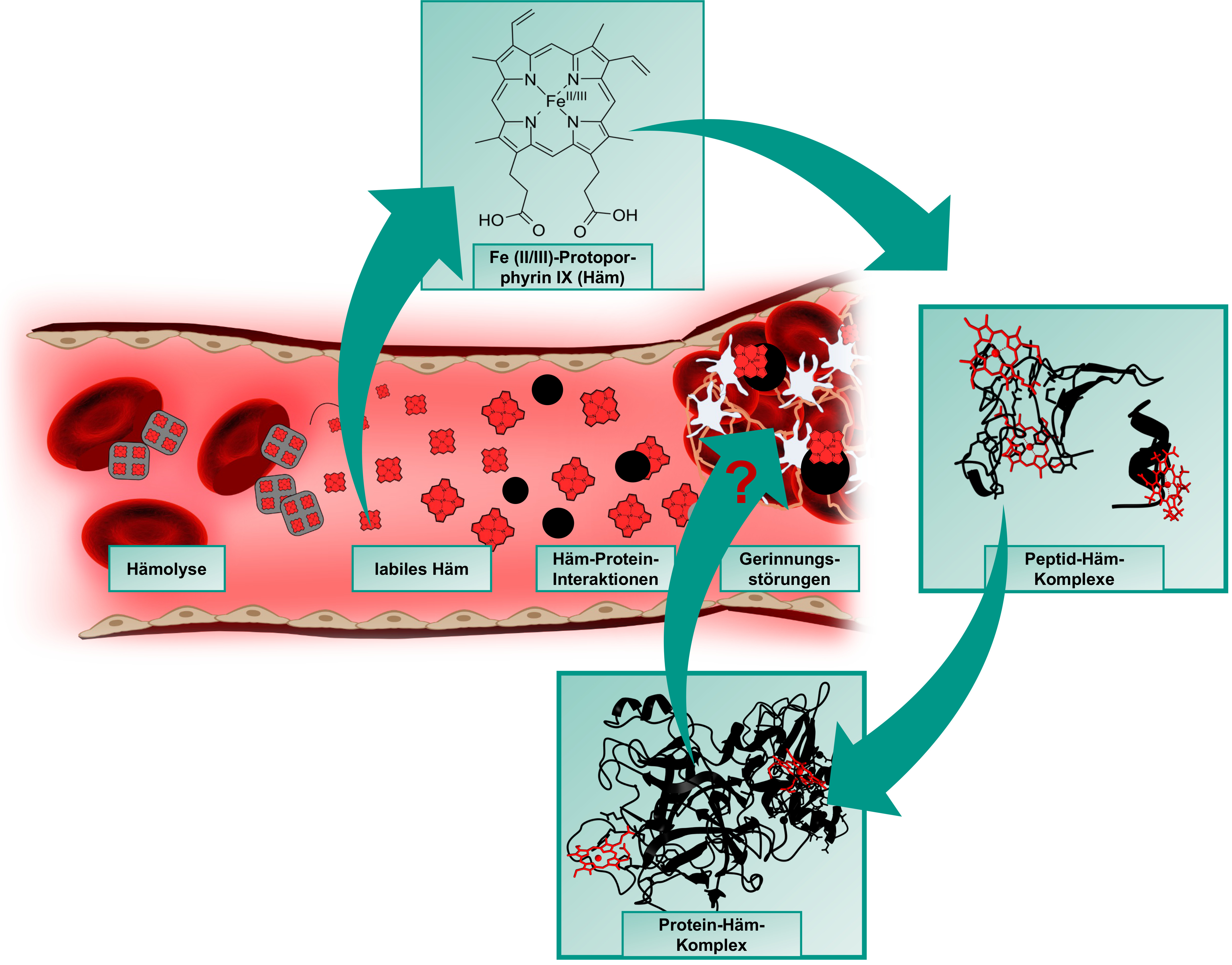
Die Komplexverbindung Häm (Eisen(II/III)-Protoporphyrin IX) ist vorrangig durch seine Rolle als Sauerstoff-bindende, prosthetische Gruppe des Hämoglobins bekannt und zirkuliert als solches in Mengen von insgesamt ~25 Trilliarden Molekülen in den Erythrozyten im Blut des menschlichen Körpers. Im Zuge von intravaskulärer Hämolyse, wie sie bei Erkrankungen, wie der Sichelzellanämie, oder als Folge von Transfusionen auftreten kann, kommt es zu einer frühzeitigen Zerstörung der Erythrozyten und so zu einer massiven Freisetzung von Hämoglobin und infolgedessen zu der Akkumulation von labilem Häm im Blut. In dieser Form kann Häm transient an Proteine binden und deren Stabilität und/oder Funktion beeinflussen [1-3].
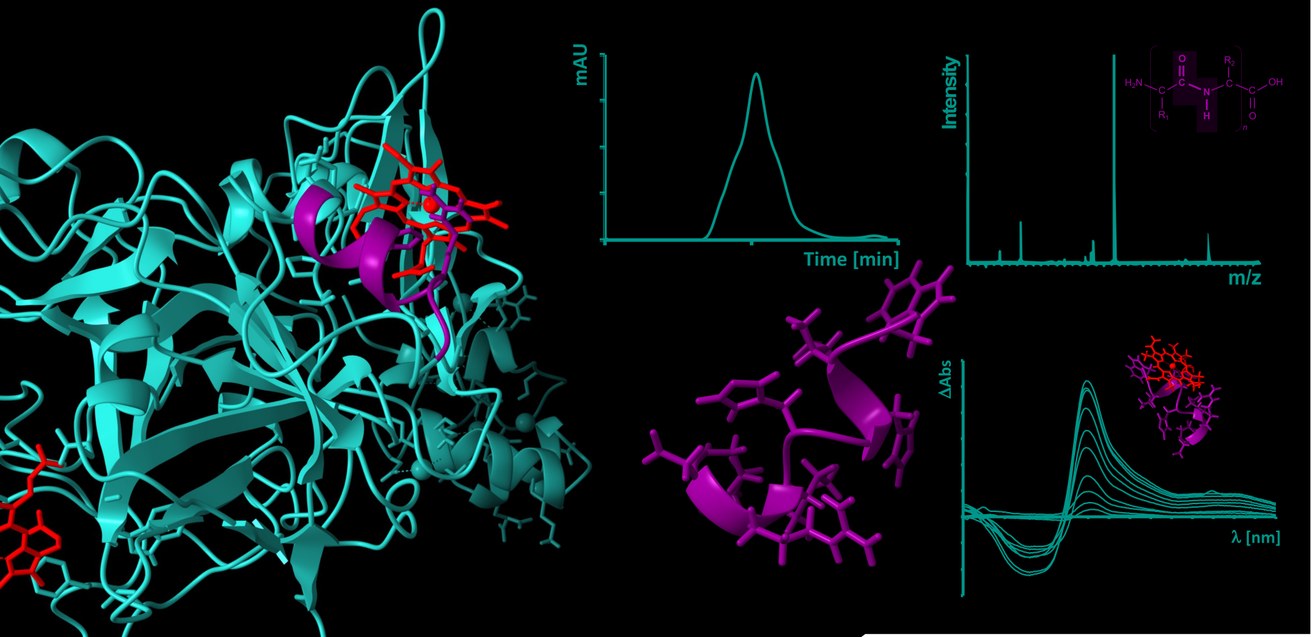
Eine der Hauptkomplikationen von hämolytischen Ereignissen stellen venöse prothrombotische Gerinnungsstörungen, wie tiefe Venenthrombosen oder Lungenembolismus, dar. Deren molekulare Grundlage ist bis heute nicht vollständig aufgeklärt, jedoch gibt es Hinweise darauf, dass auch hierbei labiles Häm und dessen Interaktion mit an diesen Prozessen beteiligten Plasmaproteinen eine Rolle spielt [4,5]. Eben diese Häm-Protein-Interaktionen sind sowohl auf molekularem Level als auch im Kontext ihrer (patho-)physiologischen Relevanz weitesgehend unerforscht. Wie zuvor bereits mit dem endogenen Gerinnungsinhibitor APC gezeigt [6], zielen wir mit unseren DFG- und GTH-geförderten Projekten (vgl. Projekte unten) nun darauf ab, das Gerinnungssystem als Häm-reguliertes System auf der Ebene der potentiellen Häm-Protein-Interaktionen unter Verwendung von Protein-abgeleiteten Peptiden zu untersuchen und zu charakterisieren.
[1] Soares, M. P., Bozza, M. T. (2016) Red alert: Heme is an alarmin. Curr. Opin. Immunol. 38, 94-100.
[2] Roumenina, L. T., Rayes, J., Lacroix-Desmazes, S., Dimitrov, J. D. (2016) Heme: Modulator of plasma systems in hemolytic diseases. Trends Mol. Med. 22(3), 200-213.
[3] Kühl, T., Imhof, D. (2013) Regulatory FeII/III heme: The reconstruction of a molecule's biography. ChemBioChem 15(14), 2024-2035.
[4] Hopp, M.-T., Imhof, D. (2021) Linking labile heme with thrombosis. J. Clin. Med. 10(3), 427.
[5] Mubeen, S., Domingo-Fernandez, D., Díaz del Ser, S., Solanki, D., Kodamullil, A. T., Hofmann-Apitius, M., Hopp, M.-T., Imhof, D. (2022) Exploring the complex network of heme-triggered effects on the blood coagulation system. J. Clin. Med. 11(19), 5975.
[6] Hopp, M.-T., Alhanafi, N., Paul George, A. A., Hamedani, N. S., Biswas, A., Oldenburg, J., Pötzsch, B., Imhof, D. (2021) Molecular insights and functional consequences of the interaction of heme with activated protein C. Antioxid. Redox Signal. 34(1), 32-48.
Amphibiensekret-Forschung
Folgt...