Molekulare Einblicke in die immunomodulierende Wirkung von Häm auf den Gerinnungsfaktor VIII
Hämophilie-A-Patient*innen leiden aufgrund eines Mangels oder Vorliegen von defektem Faktor VIII (FVIII) an Blutgerinnungsstörungen, die zu spontanen Blutungsereignissen führen können. Bei schwerer Hämophilie A handelt es sich bei 80% aller Blutungen um Gelenkeinblutungen (Hämarthrose-Episoden). Diese Blutansammlungen führt zum Abbau von Erythrozyten und somit der Freisetzung und massiven Akkumulation von extrazellulärem Hämoglobin und infolgedessen labilem Häm. Beide Komponenten sind bekannt, Entzündungsreaktionen zu induzieren. Derartige Entzündungsprozesse wurden auch im Kontext der Hämarthrose beobachtet und – bei wiederholt auftretenden Episoden – mit fortschreitender Gelenkzerstörung (hämophile Arthropathie) assoziiert. Um derartige Folgen einzudämmen bzw. zu verhindern, bietet sich bei betroffenen Patient*innen die exogene Substitutionstherapie mit FVIII durch meist intravenöse Gabe an. Eine schwere Komplikation der Behandlung mit FVIII-Präparaten stellt allerdings die Bildung von „Hemmkörpern“ dar, wobei die Immunzellen der Patient*innen den verabreichten FVIII als körperfremd erkennen und gegen FVIII gerichtete Antikörper produzieren, die dessen Wirkung hemmen. In diesem Zusammenhang wurde berichtet, dass die direkte Injektion von FVIII in die Gelenkblutung, folglich in die Hämoglobin- und Häm-reiche Umgebung, deutlich weniger Immunreaktionen auf FVIII hervorruft als bei intravenöser Gabe. Die Erforschung der molekularen Grundlage der reduzierten Immunantwort auf substituierten FVIII bei intraartikulärer Injektion in das blutende Gelenk fehlt, könnte jedoch wichtige Erkenntnisse für die Behandlung von Hämophilie-A-Patient*innen liefern.
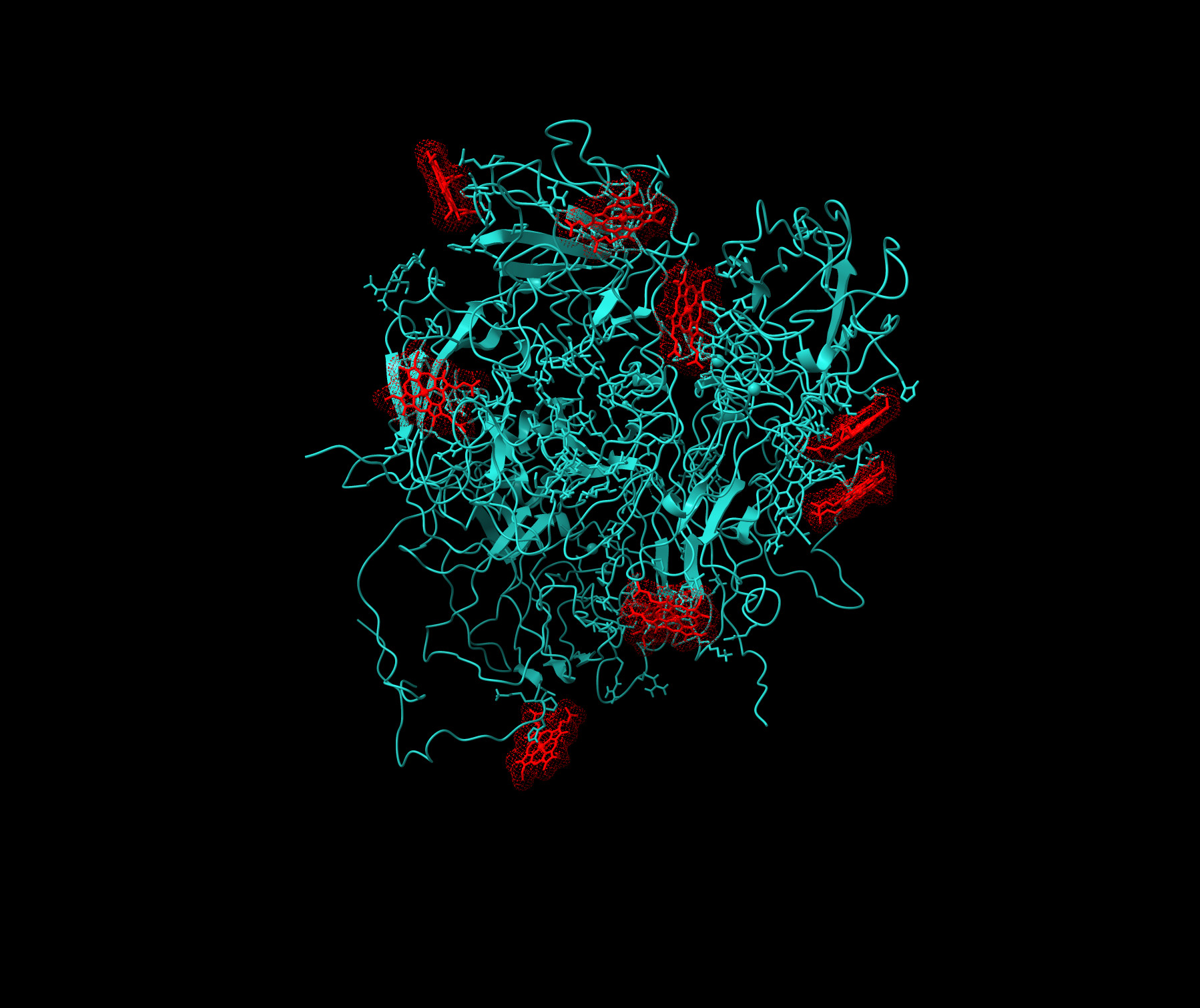
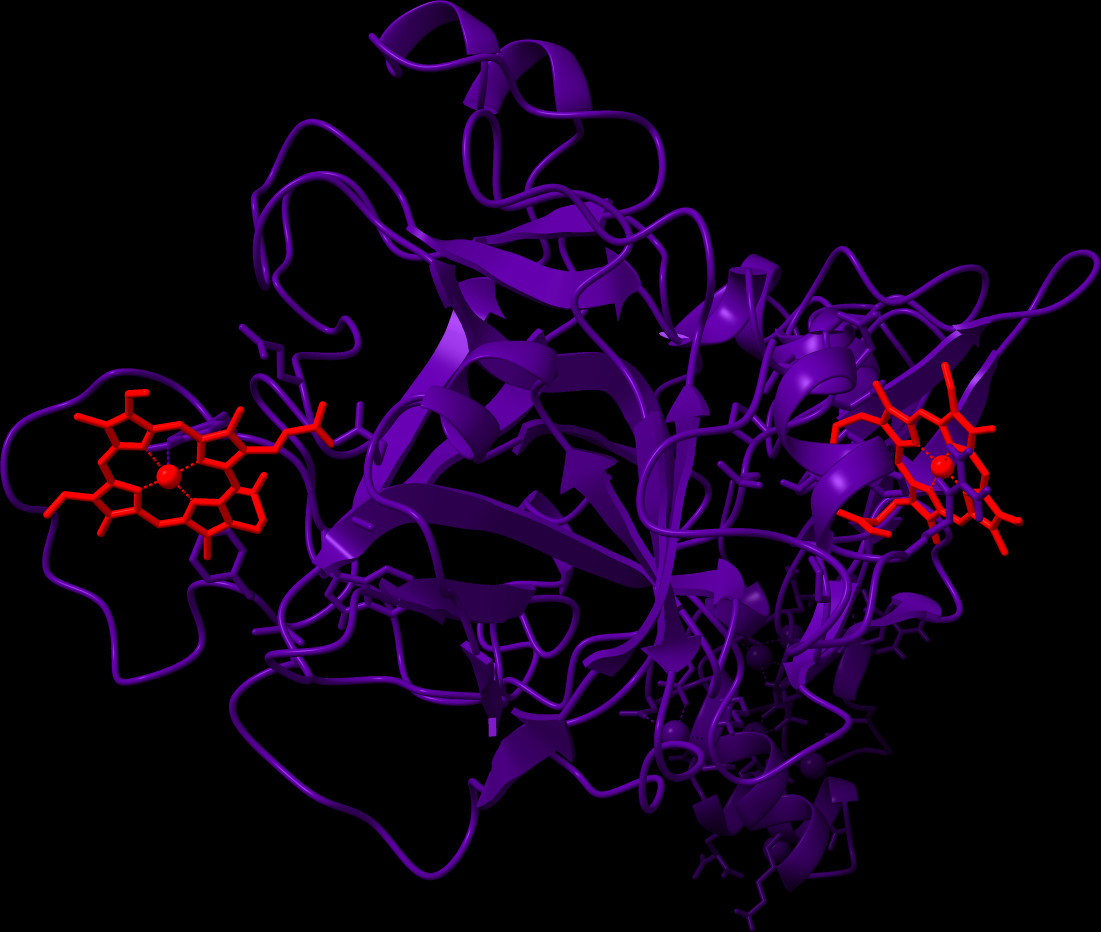
Charakterisierung der molekularen Basis von labilem Häm als prothrombotischer Modulator unter hämolytischen Bedingungen
Das Metalloporphyrin Häm ist eine Komplexverbindung aus einem zentralen Eisenion und einem Porphyrinringsystem, das als wesentlicher Bestandteil von Hämoproteinen, wie dem Sauerstofftransportprotein Hämoglobin, im Körper weit verbreitet ist. Eine unausgewogene Häm-Homöostase führt zur Freisetzung von Häm, dessen Beseitigung aus der Zirkulation i.d.R. durch mehrere Proteine, wie Hämopexin, reguliert wird. Erhöhte intravaskuläre Häm-Level werden jedoch mit prothrombotischen, zytotoxischen, proinflammatorischen und Komplement-aktivierenden Effekten in Verbindung gebracht, die die schwerwiegenden Komplikationen bei Patient*innen mit hämolytischen Erkrankungen, wie der Sichelzellanämie und transfusionsbedingter Hämolyse, kennzeichnen. In Anbetracht der hohen Prävalenz von Thrombosen und der damit verbundenen Sterblichkeit ist es erstaunlich, dass der Mechanismus der prothrombotischen Wirkungen von labilem Häm auf molekularer Ebene noch nicht vollständig aufgeklärt ist. Bei den in diesem Zusammenhang wichtigsten Proteinen, den Komponenten des Blutgerinnungssystems, sind verschiedene Proteine, darunter Faktor VIII, aktiviertes Protein C und Fibrinogen, als Häm-bindende oder sogar Häm-regulierte Proteine identifiziert worden, während andere (Thrombin, FXIIIa) kein Häm binden. Viele Fragen bezüglich einer möglichen Interaktion von Häm mit dem Großteil der Gerinnungsfaktoren sind noch offen. Dieses Projekt zielt daher darauf ab, die transiente Interaktion von Häm mit dem Gerinnungsfaktor FVIII und von Willebrand-Faktor mithilfe von biophysikalischen (z.B. UV/Vis, SPR) und strukturanalytischen (rRaman) Methoden aufzuklären. Darüber hinaus werden biochemische und hämatologische funktionelle Testsysteme sowie zelluläre Ansätze mit hoher physiologischer Relevanz (z.B. Thrombozyten- und Endothelzellenfunktionsanalyse) durchgeführt. Die gewonnenen Ergebnisse werden in den kausalen Wissensgraphen HemeKG eingearbeitet, um so die bereits bekannten prothrombotischen Effekte von Häm miteinander vernetzen zu können und bisher unbekannte Aspekte des Einflusses von Häm auf die Blutgerinnung herauszuarbeiten. Zusammenfassend werden die prokoagulierenden Wirkungen von Häm auf molekularer, biochemischer, bioinformatischer und zellulärer Ebene mit einer Vielzahl an spektroskopischen Methoden und funktionellen Assays untersucht. Dies wird eine detailliertere Charakterisierung der prothrombotischen Natur von Häm ermöglichen und neue Perspektiven für die Behandlung von Hämolyse-assoziierten Thrombosen schaffen.

Exploring the molecular basis of labile heme as a prothrombotic modulator in hemolytic disorders
The aim of this project is to provide knowledge about the molecular basis of heme-driven effects on factors of the blood coagulation system in the context of prothrombotic complications in patients suffering from hemolytic disorders.